|
段绍峰 张陈 GE药业 精准医学研究院
冠心病(coronary artery disease, CAD)是全球死亡率最高的疾病之一。近年来随着冠心病发病率和死亡率的持续上升,心血管疾病已经成为我国重大的公共卫生问题。冠心病是在冠状动脉粥样硬化的基础上,冠状动脉供血减少,心肌微循环状态失衡,引发的心肌缺血病症。目前评价冠脉狭窄程度和比例的金标准为有创性冠状动脉血管造影(invasive coronary angiography, ICA)技术,然而已有研究表明ICA并不能直接反映该狭窄引起明显的血流动力学改变导致局部心肌缺血。尽管CT扫描和成像技术新的进展出现的冠状动脉CT血管造影(coronary computed tomography angiography, CCTA)作为一种无创的影像手段已经广泛应用于冠心病患者冠状动脉狭窄的程度和疗效评估,但是它不能提供精准定量化冠状动脉血流动力学和心肌血流量信息。因此,仍然需进行心肌血流灌注成像(myocardial perfusion imaging, MPI)、测量心肌血流量(myocardial blood flow, MBF)、计算心肌和冠脉血流储备分数(fractional flow reserve, FFR)等技术提供更多关于心肌血流量、心肌活性的生理病理学信息。CT心肌灌注(myocardial CT perfusion, CTP)是在解剖学成像的基础上通过连续动态扫描(dynamic CT)获取功能学成像信息的成像方式,可以定量地评价冠状动脉狭窄与心肌血供的关系,弥补传统CCTA 临床应用的不足。
最近几年,随着容积CT和CT低剂量扫描技术在临床应用,CT动态扫描心肌灌注成像已经成为心肌血流量测量重要的技术之一。CCTA一站式完成冠状动脉造影、心肌局部血流量测量已经在临床得到广泛使用。本文就心肌局部血流量测量技术和临床应用进展进行介绍。
1.心肌血流量测量方法 心肌血流灌注图像分析包括定性、半定量和精准定量。心肌血流量测量是进行心肌血流灌注精准定量化分析的基础和前提。目前,心肌血流量测量方法均是基于传统放射性核素示踪技术原理,结合CT动态扫描技术的特点发展起来进行心肌和冠脉精准定量化分析的新型影像技术。特别是局部心肌血流量和冠脉FFR测量将冠心病影像技术从定性、半定量推进到精准定量化影像技术,加速实现冠心病精准医学目标。
(1)CT动态扫描方案:对于CT静息或负荷心肌灌注检查,采用门控技术,于对比剂在升主动脉开始上升前4 s进行扫描,根据心率于R波后175~250 ms触发扫描以获取收缩末期图像。体重指数(body mass index, BMI)≤30 kg/m2的患者,管电压和管电流分别为80~100 kV和200 mAs。采用双期注射方案先以5.0 mL/s的流率注入浓度为320 mg I/mL 的对比剂40 mL,然后以5.0 mL/s的流率注入20 mL盐水。层厚选择0.625 mm,采用自动毫安技术和自适应统计迭代重建技术(adaptive statistical iterative reconstruction, ARIS)能够显著降低对受检者的辐射吸收剂量。对负荷期扫描,其CT动态扫描的参数需要做相应的调整,以获得高质量的CT图像。
(2)心肌血流量测量模型:心肌局部血流量(regional myocardial blood flow, rMBF)测量,首先需要获取动脉输入函数(input arterial function, AIF)和局部心肌组织的对比剂浓度变化曲线。以升主动脉作为动脉输入函数(AIF),整个心肌作为感兴趣组织(region of interest, ROI),以单个像素(pixel)为单位,以获得心肌局部血流量(rMBF)。图1是降主动脉AIF和心肌组织时间衰减曲线(time attenuation curve, TAC)示意图。获得AIF、ROI心肌组织的时间衰减曲线(TAC)就可以采用心肌血流模型计算心肌局部血流量。
迄今,常用于心肌血流量计算的数学模型有:最大斜率模型(maximum slope model, slope)、双室模型(two compartment model, 2-Comp)、轴向分布模型(axially distributed model, Distr)和改良的两室模型法(modified two compartment model)等方法。本文简要介绍前三种MBF计算模型的方法和它们各自特点。
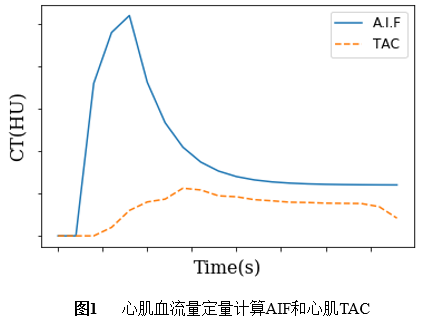
1) Slope模型:斜率模型是假设对比剂到达心肌组织速率与血流速度正相关。心肌血流量(MBF)(ml/min/g)与心肌组织TAC和动脉输入函数AIF最大值关系为公式(1)。最大斜率方法简单、方便,但是对对比剂注射速度、方式要求严格,而且易受多种因素影响[6]。在实际使用中通常采用心肌TAC上升段平均斜率来替代最大斜率。
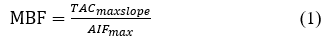
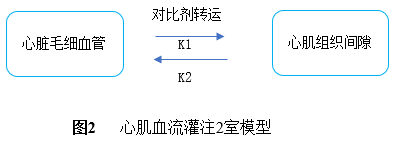
2)2 -Comp模型:2室模型是假设对比剂在毛细血管与心肌组织之间服从2室分布规律。对比剂不但可以通过毛细血管进入心肌组织间隙,而且从组织间隙还可以返回到毛细血管(见图2)。对比剂在毛细血管和组织间隙中处于动态过程[7,8]。假如设心肌组织TAC为CT(t),动脉AIF为Ca(t),从毛细血管到组织间隙和从组织间隙到毛细血管对比剂扩散(转运)常数分别为K1、K2。那么心肌组织血流量可以用(2)式公式表示。通过(2)就可以计算出心肌局部血流量。2室模型与最大斜率计算心肌血流量模型比较,它考虑到对比剂在心肌组织间隙可能返回毛细血管的因素。2室模型能够获得更多的心肌血流灌注、心肌组织毛细血管通透性的血流动力学参数。但是,与最大斜率方法相比较,2室模型计算比较复杂。
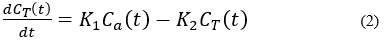
3) Distr模型:毛细血管的长度远远大于其直径,这样对比剂在毛细血管内就形成了浓度梯度差(见图3)[9]。这种现象在放射性示踪剂基础的首次通过“弹丸”血流量计算中队结果影响很小,但是对于CT对比剂,由于注射体积大,容易在毛细血管中形成大的浓度梯度,这就需要对其进行校正。通过Distr 模型校正后提高心肌血流量结果的准确度。
除选择的心肌血流量模型对心肌血流量结果有影响外,对AIF、心肌组织TAC曲线的拟合、平滑也会影响到MBF的结果。在进行实际应用中,需要优化拟合方法和平滑方法。
(3)心肌血流灌注获得定量参数和MBF显示:通过上述的心肌血流量计算模型能够获得心肌血流定量参数,这些包括心肌血流量(MBF)、心肌血容量(myocardial blood volume, MBV)、达峰时间(time to peak, TTP)、组织通过时间(tissue transit time, TTT)和血管组织渗透(permeability surface, PS)等。这些定量化参数是对冠心病进行精准诊断、精确疗效评估基础和前提。 为了更好地显示左心室局部心肌血流量,采用传统的靶心图(Bull’s Eye)将左心室分成17节段,与冠脉血供对应。采用伪彩色显示心肌局部血流量,并按照参考值把心肌血流量减低部分显示出来。
2. 心肌血流量在冠心病诊断、疗效评估应用 心肌血流量测量在冠心病早期诊断、疗效评估具有重要的价值。核医学影像技术在心肌血流量灌注研究中已经积累丰富的临床经验,并且被作为无创心肌血流灌注成像临床“参考标准”。但是核医学成像技术受到放射性药物限制,影响成像时间和朝着临床普及化方向的发展。采用CT低剂量成像技术,在获得CCTA图像同时获得心肌局部MBF已经成为临床研究的热点。Ho 等学者报道,采用常规体部血流灌注软件计算心肌局部血流量方法,对35例受检者进行研究[10],获得心肌血流量和CFR结果见表1。可以看出负荷试验和CFR对于心肌缺血的诊断比起单独的静息态MBF具有更重要的临床价值。

冠心病PET和SPECT心肌血流灌注成像已经被临床广泛接受。近10年来学者的研究结果证实了心肌正常灌注和低灌注区域MBF存在显著差异,CTP与SPECT-MPI发现的灌注缺损进行对比,基于血管节段的CTP的敏感性、特异性、PPV、NPV分别为85%, 92%, 55%, 98%。CTP、CTA单一检查手段与ICA比较对血管狭窄检测的敏感性、特异性、PPV、NPV分别为100%,76%,54%,100%;90%,54%,35%,95%。将CTA与CTP两种手段结合使用敏感性、特异性、PPV、NPV可分别达到90%,81%,58%,97%。这些研究结果表明CT动态扫描获得MBF在冠心病诊断具有重要价值,如果将CT-CTP与CTA等结合起来会给临床提供更加丰富的信息。林路等在先前工作基础上,在新一代CT设备上采用CT低剂量心脏一站式成像获得冠脉解剖结构、局部MBF、心脏功能和FFR等,显著提高对冠心病诊断的准确性。
3. 心肌局部血流量测量方法进展 由于早期CT设备成像技术限制,MBF的计算采用常规体部血流量计算方法,获得MBF结果变化很大,影响在临床的实际应用。随着CT成像技术发展,以及计算机运算功能不断提高,基于CT动态扫描心肌血流量测量技术在数学模型、计算方法和三维显示技术上都得到很大的改进,以双室模型结合轴向分布模型计算心肌血流量获得结果更为准确,参数更多。大数据建立为人工智能化诊断和预测提供全新的平台,在临床应用上CT动态扫描以“一站式”完成CCTA和MBF方法更受临床欢迎。
综上所述,随着CT技术、计算机运算功能、新的心肌血流量计算模型建立,相信心肌局部血流量的计算会更加精确,心肌局部血流量定量技术将在冠心病诊断和疗效评估中发挥更大的作用。
参考文献 陈维伟,高林,刘力生,等. 《中国心血管病报告》概要[J]. 中国循环杂志, 2016;31(6):521-528. Caruso D, Eid M, Schoepf UJ, et al. Dynamic CT myocardial perfusion imaging[J]. European Journal of Radiology. 2016; 85:1893–1899. Huber AM, Leber V, Gramer BM, et al. Myocardium: dynamic versus single-shot CT perfusion imaging[J], Radiology.2013;269: 378–386. 王成英,孙凯. CT动态负荷心悸灌注临床研究进展[J]. 放射学实践. 2017;32(5):542-545. Bindschadler M, Modgil D, Brandch KR, et al. Comparison of blood flow models and acquisitions for quantitative myocardial perfusion estimation from dynamic CT[J]. Phys Med Biol.2014;59(7):1533-1556. George RT, et al. Quantification of myocardial perfusion using dynamic 64-detector computed tomography[J]. Investigative radiology. 2007; 42(12):815–22 Cheong LHD, Lim CCT, Koh TS. Dynamic contrast-enhanced CT of intracranial meningioma: comparison of distributed and compartmental tracer kinetic models--initial results[J]. Radiology.2004; 232(3):921–30. Brix G, et al. Regional blood flow, capillary permeability, and compartmental volumes: measurement with dynamic CT--initial experience[J]. Radiology. 1999; 210(1):269–76. Koh TS, et al. A physiologic model of capillary-tissue exchanges for dynamic contrast-enhanced imaging of tumor microcirculation[J]. IEEE transactions on bio-medical engineering. 2003; 50(2):159–67. Ho KT, Ong HY, Tang G, et al. Dynamic CT myocardial perfusion measurements of resting and hyperaemic blood flow in low risk subjects with 128 slice dual source CT[J]. Eur Heart J Cardiovasc Imaging. 2015;16(3):300-306. 王怡宁,金征宇. CT心肌灌注成像. 365度医学网 文章号 W090159 林路, 王怡宁, 易妍, 等. 第3代双源CT低剂量心脏一站式成像的可行性[J]. 中国医学科学院学报, 2017,39(1): 34-41.
|