|
作者:张学喜, 张陈 GE药业 精准医学研究院
三、基于功能分子影像技术对肿瘤治疗疗效评价 从Moertel等在1976年报告基于体检方法对实体瘤治疗疗效评价,到WHO实体瘤治疗疗效评价标准(1979年),再发展到RECIST(2000)、RECIST1.1实体瘤治疗疗效评价标准。这些均是基于肿瘤解剖结构变化来评价治疗疗效。然而,许多年来已经有确切的证据表明,核医学分子影像技术可以提供独特的、生物学相关的、不可能通过解剖成像技术获得对肿瘤治疗预后的重要信息。有学者认为分子影像定量成像方法可以作为肿瘤疗效预测或治疗效果评价的生物学标志。 Yong等1999年发表采用18F-FDG PET 评价肿瘤治疗疗效的EORTC标准。该标准首次提出采用18F-FDG PET评价肿瘤治疗疗效。但是,该方法采用肿瘤病灶对18F-FDG 摄取率(standardized uptake value, SUV)作为评价肿瘤疗效指标。然而,采用体重校正的SUV存在重复性差、变异大,并且没有设置可观的参考本底的不足。另外,尽管该标准提出18F-FDG PET采集和图像处理的质量控制要求,但是缺乏严格的定量化的要求。随着PET/CT在临床广泛使用,以及EORTC在临床使用经验的积累。2009年Wahl Richard L在回顾WHO、RECIST实体瘤治疗疗效评价标准基础上,结合18F-FDG PET和PET/CT在肿瘤治疗效果预测和评价研究的大量数据后,提出实体瘤疗效PET评估标准1.0版本框架草案-PERCIST标准。PERCIST1.0标准建立在用PET评价肿瘤疗效是在连续的和不同时间点上监测肿瘤对18F-FDG摄取变化基础上。 (一) EORTC实体瘤治疗疗效评价 1. EORTC标准对肿瘤病灶基线期的定义 (1)可测量病灶与不可测量病灶的定义: 1)评价参数的确定:使用PET设备。可测量的病灶是指单个摄取18F-FDG的病灶。病灶对18F-FDG摄取测量采用病灶感兴趣区(ROI区)SUV或MRglu。选择肿瘤具有摄取最高18F-FDG摄取区域,在治疗前扫描中勾画ROI。 2)肿瘤病灶基线确定:参照肿瘤诊断的标准。 2. EORTC标准对肿瘤疗效评价 (1)靶病灶的疗效评价 CMR:肿瘤内的18F-FDG完全消失至不能与周围正常组织鉴别。 PMR:一个肿瘤化疗疗程后肿瘤18F-FDG SUV摄取至少降低15%-25%,一个疗程以上降低>25%;PMR并不要求肿瘤摄取18F-FDG范围缩小。 PMD:在基线扫描确定的肿瘤区域肿瘤18F-FDG SUV增加>25%;肿瘤18F-FDG摄取范围可见增加(最大长轴20%)或表现新的18F-FDG摄取灶。 SMD:病灶18F-FDG SUV增加<25%,或降低<15%,或未发现肿瘤18F-FDG摄取范围增加(最大长轴20%)。 (二)PERCIST1.0标准草案 1. PERCIST1.0标准草案对肿瘤病灶基线期的定义 (1)可测量病灶与不可测量病灶的定义: 1)评价参数的确定:可测量的病灶是指单个摄取18F-FDG的病灶。病灶对18F-FDG摄取测量采用病灶感兴趣区域(ROI)峰值替代传统的最大值或平均值。峰值是在1.2厘米直径球体内获得1厘米3最高值。采用SUL(Lean Body Mass)取代传统的SUV。 2)肿瘤病灶基线确定:按照肿瘤病灶的SUL峰值应当是1.5´肝脏平均SUL+2倍标准差。如果肝脏有疾病,那么肿瘤病灶最小有代谢可测量肿瘤的活性可以看作2.0´血池活性+2倍纵隔标准差。 3)肝脏和血池本底选择:在肝脏右下叶勾画3厘米ROI作为本底区(不能包含大血管组织)(见图2)。假如肝脏异常,原发肿瘤摄取应当>2.0 ´SUL (在降主动脉)。 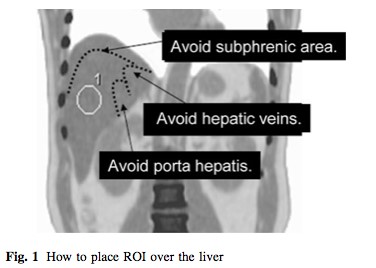 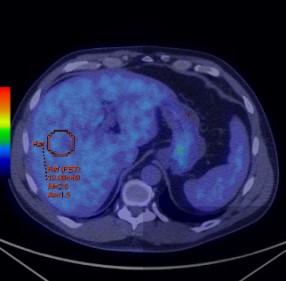
图2 在肝脏勾画本底ROI示意图 4)不可以测量的病灶是指并未摄取18F-FDG病灶。 (2)靶病灶和非靶病灶: 当存在多个可以测量的病灶时,按照病灶大小及可以重复测量的原则,每个脏器最多选取2个病灶,总共不超过5个病灶作为靶病灶。靶病灶以外的所有病灶被看作为非靶病灶。 2、PERCIST标准对肿瘤疗效评价 (1)靶病灶的疗效评价 CMR:在可测量的靶病灶18F-FDG摄取完全消失以至于低于肝脏平均放射活性,并且不能与血池本底相区别。所有其它病灶消失至血池本底水平。在可以测量区域SUL降低应该记录,治疗开始后的时间也应该记录(比如,CMR -90,4)。假如RECIST是进展疾病,应该通过随访来验证。 PMR:在可测量靶肿瘤18F-FDG SUL峰值降低至少30%。最好,SUL绝对值下降到至少是0.8 SUL单位。测量通常是在同一病变作为基准,但也可以是不同病变。如果病变以前存在,治疗后是目前最活跃的病变。对于PMR并不要求肿瘤18F-FDG摄取范围减少。SUL降低的百分数应该记录,还有治疗开始后时间(周)(比如,PMR -40,3)。并没有新的病灶出现。 PMD:18F-FDG SUL峰值增加30%,并且与基准扫描相比,肿瘤峰值SUV增加大于0.8SUL单位,该肿瘤具备典型肿瘤模式,没有炎症或治疗效应。或者:18F-FDG肿瘤摄取可见范围扩大(TLG体积75% ,SUL没有降低)。SMD:不是CMR、PMR或PMD,在代谢目标病灶SUL峰值应该被记录,还应该有最近开始治疗的时间(周)(例如,SMD -15, 7)。 (2)非靶病灶疗效评价 CMR:所有18F-FDG病灶消失。 PMD:18F-FDG非目标病灶明显进展或典型肿瘤18F-FDG摄取呈现新的病灶。 SMD:即不满足CMR,又不是PMD。 3、PERCIST 1.0与EORTC标准的比较 表3是PERCIST 1.0与EORTC标准比较。可以看出EORTC和PERCIST1.0标准在肿瘤基线确定、评价参数的选择、以及疗效评价均存在明显的不同。PERCIST1.0是建立在PET/CT基础之上,强调在严格规范使用18F-FDG PET/CT前提下从定量化角度来评价肿瘤治疗疗效。 表3 PERCIST 1.0与EORTC比较 特征 | EORTC | PERCIST1.0 | 在基线可测量病变 | 肿瘤对18F-FDG摄取采用SUV | 采用ROI峰值和SUL。并且对病灶的选择按照参考值进行。需要计算TLG。规定靶器官病灶选择的总数目。 | 摄取归一化 | 扫描仪应该提供数据的重复性。 | 正常肝脏SUL应该是在20%(并且0.3SUL平均单位)作为基线和后续研究研究评价疗效。 | 客观疗效 | PMR、PMD均采用相对变化。 | 在PMR、PMD中进入SUL绝对单位量,并且强调需要记录从化疗开始到显像的时间。在PMR中采用TLG。 对非靶病灶具有明确的规定 | 总体疗效 | - | 最佳总疗效是指可测量病灶从治疗开始到疾病进展或复发之间所测量的最小值。 可测量肿瘤或不可测量非靶病灶非-PMD从CR退到总体PMR。 非靶病灶非-PMD并未退到PR。 | 总缓解期 | - | 总CMR:从治疗后首次评价为CMR时直至经评价为疾病复发获进展时间。 总体疗效:从治疗后经首次评价为CMR或PMR时直至评价为疾病复发或进展时间。须注意,CMR或PMR应在首次评价为CMR或PMR的4周后确认才能被认为是有效的。 SMD:从治疗开始到首次被确定为PMD时间。 |
4. RECIST1.1与PERCIST1.0标准比较 表4是RECIST1.1与PERCIST1.0实体瘤治疗疗效标准比较。在基线测量依据、可测量病灶、不可测量病灶和疗效评价方面两者均明显不同。RECIST和PERCIST标准之间存在极好的互补性。对于不摄取18F-FDG肿瘤病灶或以细胞毒性治疗为主的治疗时,RECIST标准是最佳的选择,而对于以靶向治疗药物为主,或希望监测到肿瘤治疗早期的治疗疗效,那么PERCIST是最佳的选择。也有将两者联合使用的情况。 表4 RECIST1.1与PERCIST1.0实体瘤治疗疗效标准比较 | RECIST1.1 | PERCIST1.0 | 基线测量依据 | 依据解剖结构 | 依据肿瘤病灶对18F-FDG摄取,采用PET/CT扫描 | 可测量病灶 | 病灶依据解剖结构测量病灶最长长轴 | SUL峰值 | 不可测量病灶 | 小的、不可见病灶 | 病灶并不摄取18F-FDG | 疗效评价 | CR、PR、SD、PD | CMR、PMR、SMD、PMD |
在不断总结基础和临床研究经验的基础上,目前RECIST1.1和 EORTC、PERCIST1.0标准已经在分子影像图像处理工作站上可以全自动化完成操作过程,并获得CMR、PMR、SMD和PMD的描述。这样极大地推动了RECIST和PERCIST标准普及化使用过程。 四、基于影像组学技术对肿瘤疗效评估研究进展 影像组学是指采用高通量、全自动化计算方法将医学图像中病灶ROI的影像数据转化为具有特征信息的定量化数据,并对特征空间区域的数据进行精准定量化分析,以从结构形态、组织细胞、分子和基因遗传等各种表型(phenotype) 综合评价疾病,实现精准医学目标。 医学影像组学技术已经被用于对肿瘤良恶性诊断和鉴别诊断、疗效评估和预测等。Aerts等报道CT头颈部肿瘤采用影像组学技术对患者预后评估。他们采用4类影像组学特征建立比例风险回归模型(proportional hazards model,简称Cox模型)预测患者的预后,并取得预期结果。Fave等采用CT影像特征对非小细胞肺癌(non–small cell lung cancer, NSCLC)治疗疗效进行评估。Li等采用全自动方法对脑胶质瘤多参数MR图像提取,获得图像特征并用于对预后的分析。Liu等采用影像组学方法对局部进展期直肠癌新辅助放化疗疗效进行预后评价,通过治疗前后患者的MR图像建立的影像组学模型以较高的准确率实现对病理完全缓解(pathologic complete response,PCR)的个体化、非侵入式的预测。Altazi等将放射组学特征对患者治疗反应的分类与PET SUV测量结果想对比,结果发现影像组学特征能够区分无疾病(no evidence of disease)、带病生存(alive with disease);和疾病死亡(dead of disease)三种不同类型的治疗结果。对乳腺癌分子分型的研究发现,影像组学方法可以以较高的预测准确率实现对Luminal A,Luminal B,HER2+以及Basal Like的分类预测。 采用影像组学技术具有可视化、定量化和智能化的特点实现对实体瘤疗效评估是很有潜力的,影像组学技术可以采用不同影像模式、用于不同类型实体瘤。在肿瘤分子分型领域以及肿瘤放化疗疗效评估方面已经取得了一些令人振奋的研究成果,在后续的研究中影像组学技术也有希望指导分子靶向治疗、细胞治疗和免疫治疗以及实现对肿瘤不同治疗技术的疗效评估。 综上所述可以看出,为了不断满足临床前期研究、临床应用的需求,从WHO实体瘤治疗疗效标准到RECIST1.1标准,发展到基于分子影像技术基础的PERCIST1.0标准,再发展到采用影像组学技术对肿瘤疗效评估。PERCIST1.0是建立在RECIST1.1标准基础之上,采用分子影像技术对肿瘤治疗,特别是靶向治疗疗效进行客观评价。PERCIST标准作为客观评价肿瘤靶向治疗标准,对于推动个性化治疗具有重要的价值。目前,PERCIST1.0标准仅适应于对18F-FDG摄取的肿瘤,而且对PET/CT采集处理方法具有严格的要求。所以,PERCIST1.0标准还有待于进一步的完善。影像组学技术在肿瘤疗效评估处于探索阶段,目前的研究显示影像组学技术对于不同体部肿瘤具有很好的预测评估能力,但还有很多的技术问题有待解决。 参考文献 Karrison TG, Maitland ML, Stadler WM, Ratain MJ. Design of phase II cancer trials using a continuous endpoint of change in tumor size: application to a study of sorafenib and erlotinib in non small cell lung cancer. J Natl Cancer Inst 2007; 99:1455–1461. Rosner GL, Stadler W, Ratain MJ. Randomized discontinuation design: application to cytostatic antineoplastic agents. J Clin Oncol 2002; 20:4478–4484. Ratain MJ, Sargent DJ. Optimising the design of phase II oncology trials: the importance of randomisation. Eur J Cancer 2009; 45:275–280. Schuetze SM, Baker LH, Benjamin RS, Canetta R. Selection of response criteria for clinical trials of sarcoma treatment. Oncologist 2008; 13(suppl 2):32–40. WHO handbook for reporting result of cancer treatment. Offset Publication No.48. Geneva (Switzerland): World Health Organization, 1979. Ratain MJ, Eckhardt SG. Phase II studies of modern drugs directed against new targets: if you are fazed, too, then resist RECIST. J Clin Oncol 2004; 22:4442–4445. 原发性肺癌诊疗规范(2011年) 卫办医政发[2011]22号 廖美琳 主编 肺癌化疗和靶向治疗 人民卫生出版社 北京2009年 144-149页 杨学宁,吴一龙。实体瘤治疗疗效评价标准-RECIST。循证医学 2004;2: 85-111 徐建明 肿瘤靶向药物治疗的疗效评价。中国使用外科杂志 2010;7:529-531 Schwartz LH, Bogaerts J, Ford R, et al. Evaluation of lymph nodes with RECIST 1.1. Eur J Cancer 2009; 45:261–267. Young H, Baum R, Cremerius U, et al. Measurement of clinical and subclinical tumor response using [18F]-fluorodeoxyglucose and positron emission tomography: review and 1999 EORTC recommendations. European Organization for Research and Treatment of Cancer (EORTC); PET Study Group. Eur J Cancer. 1999; 35:1773–1782. Wahl Richard L., Jacene Heather, Kasamon Yvette, and Lodge Martin A. From RECIST to PERCIST: Evolving Considerations for PET Response Criteria in Solid Tumors. J Nucl Med 2009; 50:122S–150S Kaplan WD, Jochelson MS, Herman TS, et al. Gallium-67 imaging: a predictor of residual tumor viability and clinical outcome in patients with diffuse large-cell lymphoma. J Clin Oncol 1990; 8:1966–1970 Israel O, Front D, Lam M, et al. Gallium 67 imaging in monitoring lymphoma response to treatment. Cancer 1988; 61:2439–2443 Di Chiro G, Brooks RA. PET-FDG of untreated and treated cerebral gliomas. J Nucl Med 1988; 29:421–423 Di Chiro G, Oldfield E, Wright DC, et al. Cerebral necrosis after radiotherapy and/or intra-arterial chemotherapy for brain tumors: PET and neuropathology studies. AJR 1988; 150:189–197 Hoekstra OS, van Lingen A, Ossenkoppele GJ, Golding R, Teule GJ. Early response monitoring in malignant lymphoma using fluorine-18 fluorodeoxyglucose single-photon emission tomography. Eur J Nucl Med 1993; 20:1214–1217 Wahl RL, Zasadny K, Helvie M, Hutchins GD, Weber B, Cody R. Metabolic monitoring of breast cancer chemohormonotherapy using positron emission tomography: initial evaluation. J Clin Oncol 1993; 11:2101–2111. Juweid ME, Cheson BD. Positron-emission tomography and assessment of cancer therapy. N Engl J Med 2006; 354:496–507. Lu W, Chen WG. Positron emission tomography/computerized tomography for tumor response assessment—a review of clinical practices and radiomics studies. Transl Cancer Res. 2016; 5(4): 364–370. Aerts H J W L, Velazquez E R, Leijenaar R T H, et al. Decoding tumour phenotype by noninvasive imaging using a quantitative radiomics approach. Nature Communications, 2014, 5:4006. Gillies RJ, Kinahan PE, Hricak H. Radiomics: Images Are More than Pictures, They Are Data. Radiology. 2016; 278(2): 563–577 Subbiah V, Chuang H H, Gambhire D, et al. Defining Clinical Response Criteria and Early Response Criteria for Precision Oncology: Current State-of-the-Art and Future Perspectives. Diagnostics, 2017, 7(1):10. Li Q, Bai H, Chen Y, et al. A Fully-Automatic Multiparametric Radiomics Model: Towards Reproducible and Prognostic Imaging Signature for Prediction of Overall Survival in Glioblastoma Multiforme. Scientific Reports. 2017; 7: 14331. doi:10.1038/s41598-017-14753-7. Liu Z, Zhang X Y, Shi Y J, et al. Radiomics Analysis for Evaluation of Pathological Complete Response to Neoadjuvant Chemoradiotherapy in Locally Advanced Rectal Cancer. Clinical Cancer Research, 2017: clincanres.1038.2017. Altazi B, Fernandez D, Zhang G, et al. SU-E-J-258: Prediction of Cervical Cancer Treatment Response Using Radiomics Features Based on F18-FDG Uptake in PET Images Medical Physics, 2015, 42(6Part11):3326-3326. Sun X, He B, Luo X, et al. Preliminary Study on Molecular Subtypes of Breast Cancer Based on Magnetic Resonance Imaging Texture Analysis. Journal of Computer Assisted Tomography, 2018:1. Chang R F, Chen H H, Chang Y C, et al. Quantification of breast tumor heterogeneity for ER status, HER2 status, and TN molecular subtype evaluation on DCE-MRI. Magnetic Resonance Imaging, 2016, 34(6):809-819.
|